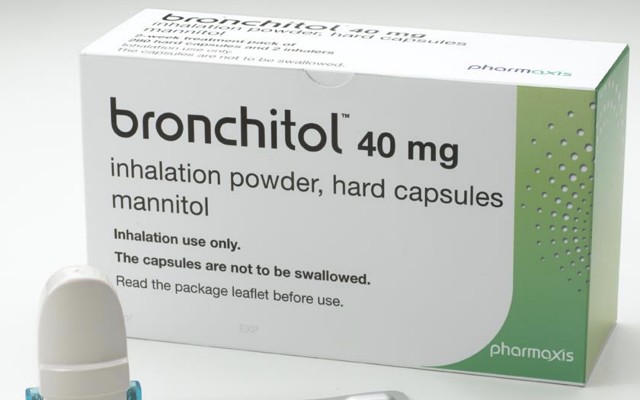
在被描述为一个“变革的一步”Pharmaxis (ASX: PXS)拿了美国食品和药物管理局批准其Bronchitol药物(甘露醇)用于国家作为囊性纤维化患者的辅助治疗。
FDA的批准意味着Pharmaxis可以销售一种可吸入的干粉Bronchitol,作为全美18岁以上囊性纤维化患者的辅助维持疗法。
Bronchitol已经在澳大利亚、俄罗斯和欧洲上市。
Pharmaxis首席执行官Gary Phillips表示,获得FDA批准在美国销售Bronchitol对公司来说是“转型的一步”。
US推出
Pharmaxis在美国的授权公司Chiesi Farmaceutici带领该药物通过了FDA批准的最后阶段。
作为美国分销协议的一部分,Chiesi将向Pharmaxis支付700万美元。一旦Pharmaxis将Bronchitol运到基耶西,它将再得到300万美元。
该公司计划于明年第一季度在中国进行商业发射。Pharmaxis预计将获得版税收入,相当于Chiesi在美国Bronchitol净销售额的20%。此外,当Chiesi达到年度销售门槛时,Pharmaxis将获得总计1500万美元的三个销售里程碑。
在FDA批准Bronchitol之前,Pharmaxis公司的Aridol肺功能测试已经在美国上市。
预计Bronchitol在美国的销售将贡献现有的现金流从其他地区和Aridol销售。
因此,Pharmaxis预计从2021财年开始其现金流将为正。
Phillips先生说:“美国市场占全球囊性纤维化市场的60%以上,所以今天FDA批准的公告对Pharmaxis来说是重要而积极的影响。”
“Pharmaxis将在我们的悉尼工厂生产更多的Bronchitol,供应美国,而不是澳大利亚和其他17个国际市场,这将极大地提高产能利用率,从而从根本上提高商品成本。”
资助PSS-5505的开发
Phillips表示,来自Chiesi的资金,再加上来自该公司甘薯醇部门的现金流,将使Pharmaxis能够推进其领先候选药物PSS-5505的研发,该药物旨在治疗骨髓癌骨髓纤维化。
甘露醇部分销售收入预计将涵盖PSS-5505的开发,直至二期试验结束。
Pharmaxis公司的PSS-5505已经获得了FDA的新药审批和孤儿药认定。
该公司现在将进行一项公开标签研究,在澳大利亚和国际上招募多达42名骨髓纤维化患者。
Pharmaxis将PSS-5505描述为一种抑制剂,它试图逆转导致该病发病的骨髓纤维化。
Phillips表示,该公司希望将其作为单一疗法或已获批准的治疗骨髓纤维化疗法的辅助疗法出售。