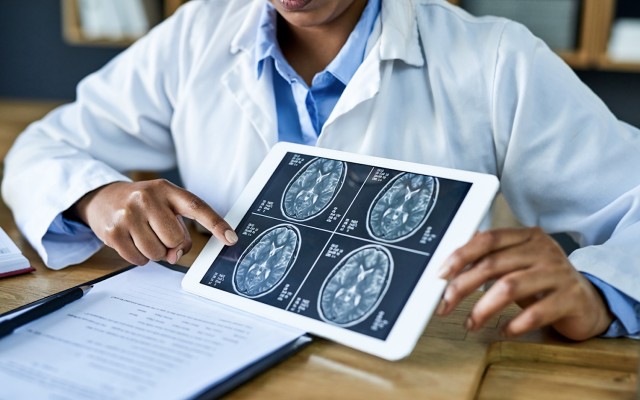
Kazia Therapeutics (ASX: KZA) 披露了临床前数据,表明其药物 paxalisib 在两种形式的儿童脑癌中表现出活性,在这种情况下,未满足的医疗需求非常高。 该公司在新奥尔良举行的American Association for Cancer Research (AACR) 年会上公布了临床前数据。 根据 Kazia 的说法,这是首次在这种被称为非典型畸胎瘤/横纹肌瘤的脑癌中探索 paxalisib 的数据。 这些是从大脑和脊髓开始的罕见且快速生长的肿瘤。肿瘤通常出现在三岁及以下的儿童身上。 在Baltimore的Johns Hopkins University工作的科学家在他们的报告摘要中将 paxalisib 描述为治疗非典型畸胎瘤/横纹肌瘤的“骨干疗法”。 科学家们在助理教授杰弗里·鲁本斯的实验室里工作。 侵袭性儿童脑癌 来自Johns Hopkins University另一个团队的第三份摘要显示了 paxalisib 与其他癌症疗法之间的“强大协同作用”。这在弥漫性内在脑桥胶质瘤 (DIPG) 模型中得到证实。 DIPG 是另一种具有高度侵袭性且难以治疗的儿童脑肿瘤。 Kazia 指出,paxalisib 先前已在 DIPG 中显示出活性,既可以作为单一疗法,也可以与其他癌症疗法联合使用。 首席执行官James Garner博士表示,这些数据“非常有希望”。 “Paxalisib 已经是 DIPG 和弥漫性中线神经胶质瘤正在进行的 II 期临床试验的主题,这一新数据表明该药物在儿童脑癌中的潜在更广泛应用。” Paxalisib Paxalisib 是 Kazia 的主要药物,已被开发为 PI2K/Akt/mTOR… Continue reading Kazia Therapeutics 的 paxalisib 在临床前研究中显示出对罕见的儿童脑癌的活性
Tag: KZA
Kazia Therapeutics 招募首名酮症患者参加 paxalisib 治疗胶质母细胞瘤的 II 期研究
近日,肿瘤学药物开发公司Kazia Therapeutics (ASX: KZA)招募了其首个患者参与一项实验性新药paxalisib的II期研究,该药物用于治疗新诊断和复发性胶质母细胞瘤。 这项为期两年的研究由纽约Weill Cornell Medical Centre发起,将在两组患者中调查paxalisib联合糖尿病药物二甲双胍(metaformin)和生酮饮食的疗效,初始队列各16名患者。 第一组将包括新诊断的恶性胶质瘤患者,这些患者有未甲基化MGMT启动子状态,过去对目前标准的治疗药物temozolomide反应不佳。 第二组将包括接受标准治疗后病情进展的复发性疾病患者(无论其MGMT启动子的甲基化状态如何)。 在每一组中,paxalisib联合二甲双胍和生酮饮食将由临床营养师监督,以确保其科学合理,并确保患者依从。 Kazia说,如果某一特定群体出现活动信号,该群体将扩大到大约30名患者。 除了有效性和安全性,该研究还将检测一系列代谢、药效学和新型放射成像生物标志物,为未来的研究和临床实践提供信息。 低胰岛素状态 Lew Cantley教授发现了PI3K通路(人体最重要的细胞内通路之一,可被认为是癌症的主要调节因子),他的研究表明,低胰岛素状态可能会增强PI3K抑制剂(如paxalisib)的活性。 据报道,诱导生酮状态——身体由脂肪和蛋白质而不是葡萄糖提供能量——是降低胰岛素水平的有效方法。 与健康细胞不同,大多数肿瘤细胞代谢酮的能力较差,它们依赖葡萄糖来满足能量需求。 许多研究人员已经试验了“生酮饮食”作为一种潜在的癌症治疗方法。 在Kazia研究中,增加二甲双胍的治疗旨在进一步降低患者的胰岛素水平。 探索关系 该项研究的首席研究员、Weill Cornell的Brain Tumour Centre的创始主任Howard Fine博士说,这项研究将探索paxalisib、二甲双胍和生酮之间的关系。 他说:“我的同事和我相信,给处于生酮状态的患者使用paxalisib可能会显著提高其疗效,我们有广泛和非常令人信服的临床前数据支持这一方法。” “它为胶质母细胞瘤的治疗提供了巨大的潜力,胶质母细胞瘤仍然是现代医学中最具挑战性的癌症之一。” Fine博士的实验室已经证明胰岛素可以逆转PI3K抑制剂在胶质母细胞瘤细胞中的抗肿瘤作用。 他说:“由于这些原因,在胶质母细胞瘤中探索二甲双胍、生酮饮食和paxalisib的组合是有合理的理论基础的。”
Kazia Therapeutics公司在12月季度推进领先癌症药物的人体试验
专注于肿瘤学和临床阶段的生物技术公司 Kazia Therapeutics (ASX: KZA) 报告称,在截至 12 月 31 日的三个月内,其主要候选药物的开发取得了巨大进展。 工作重点是脑癌治疗药物paxalisib的研究,特别是由Global Coalition for Adaptive Research推动的针对胶质母细胞瘤的国际GBM AGILE研究。 这项研究已经在美国开展了几十个地点,并于11月向加拿大医院开放,第一个地点是Ontario省的Sunnybrook Health Sciences Centre。 更多的网站正在推出的过程中。 新药审批 去年12月,Kazia和中国Simcere Pharmaceutical收到通知,paxalisib在中国的临床新药申请已获得监管部门批准。 这一批准是在中国开展GBM AGILE的关键一步,并可能推动paxalisib的其他临床试验。 这项研究预计将于年中在中国开放招聘。 自适应设计 GBM AGILE研究最初集中在美国,目前有40多家领先的癌症医院参与其中。 它使用了一种被称为“适应性设计”的复杂而新颖的方法来调整它的统计能力。这种方法有可能大大加快时间进度和降低成本。 如果在少于200名患者之后,答案变得清晰,那么该研究将提前结束,Kazia将使用最终数据向美国食品和药物管理局(FDA)提交一份新药申请。 Paxalisib二期研究 去年12月,Kazia宣布了其在新诊断的胶质母细胞瘤患者中进行的paxalisib二期研究的最终阳性数据。 该研究报告,使用paxalisib治疗的患者中位总生存率为15.7个月,而使用现有标准护理药物temozolomide治疗的患者中位总生存率为12.7个月。 报告中位无进展生存率为8.4个月,而替莫唑胺组为5.3个月。 Paxalisib的安全性与在其他临床试验中观察到的相似,高血糖(高血糖)、粘膜炎(口腔溃疡)和皮疹是最常见的毒性反应。 血管生成的药物 去年11月,Kazia的第二种药物EVT801开始在法国Toulouse的Oncopole癌症研究中心进行一期研究招募。 今年1月,Lyons的癌症护理和研究医院Centre Leon Berard也开始招聘。 该研究将采用“剂量递增”设计,检测EVT801作为单药治疗的安全性、耐受性和药代动力学。 一旦确定了最大耐受剂量,Kazia将在两个不同的人群(肾细胞癌和软组织肉瘤)中招募更多的患者,以阐明该药物的临床活性。 第一阶段的研究旨在纳入一系列的转译生物标志物,并有望提供EVT801在癌症患者中的药理活性的有价值的数据。 1月底,该研究清除了第一剂量水平,并开始了第二剂量的治疗。 许可协议 今年4月,在与Evotec SE药物开发公司达成4.96亿澳元的许可协议后,Kazia将EVT801纳入其投资组合,该药物将通过临床试验并商业化。 研究表明,生长中的肿瘤需要大量新形成的血管和淋巴管来满足其大量的营养需求。 抑制新血管形成的药物(血管生成抑制剂)已被证明在抑制一系列实体肿瘤方面是有效的;然而,它们的使用可能受到肿瘤中低氧水平和毒性引起的治疗耐药性的限制。 EVT801已被设计用于选择性地靶向淋巴管生成(新淋巴管的形成),并有望提供许多与抑制血管生成相同的好处,减少耐药性和毒性。 儿童脑癌研究 2021年11月,Pacific Paediatric… Continue reading Kazia Therapeutics公司在12月季度推进领先癌症药物的人体试验
Kazia Therapeutics的paxalisib药物被授予治疗胶质母细胞瘤的快速通道指定
澳大利亚肿瘤生物技术公司Kazia Therapeutics (ASX: KZA)的主导药物paxalisib(原GDC-0084)被美国食品药品监督管理局授予快速通道认证,用于治疗胶质母细胞瘤。 脑胶质母细胞瘤是目前最常见和最具侵袭性的原发性脑癌。脑胶质母细胞瘤是一种严重或危及生命的疾病。 它为Kazia提供了更多接触美国FDA的机会,包括在paxalisib开发的剩余期间进行面对面的会议和书面磋商。 该指定的具体指示是“用于治疗新诊断的具有未甲基化O6-甲基胍甲基转移酶(MGMT)启动子状态的胶质母细胞瘤患者,这些患者已经完成了初始放疗,同时服用替莫唑胺”。 该适应症反映了Kazia正在进行的paxalisib II期研究的患者群体,也是国际学术界主导的多药GBM敏捷试验的主要拟议人群。 今年早些时候,Kazia被邀请将paxalisib纳入试验,预计招募工作将在年底前开始。 强大的确认 Kazia的首席执行官James Garner博士表示,该认定承认了paxalisib在脑癌治疗中的重要作用。 他说:“这是美国食品和药物管理局非常有力的承认,承认了我们的药物在改善胶质母细胞瘤患者预后方面的潜力。” “随着我们向提交新药申请迈进,这一认定创造的机会具有巨大的价值,并有可能大幅加速paxalisib的商业化。” 他说,一个显著的好处将是“滚动审查”过程,这使Kazia能够提前完成并提交其新药申请的实质性部分,节省时间并降低产品风险。 病人使用通道 根据美国食品药品管理局(FDA)的现代化法案(1997年)引入了FTD,旨在让患者尽快获得新药。 指定必须由赞助公司提出要求,并附带对临床前和临床数据的详细审查。 要获得FTD,一种药物通常必须能够在安全性或有效性方面显示出比现有疗法的某些潜在优势。 Paxalisib现在有资格获得加速审批(一种新药在获得确切数据之前获得批准)和优先审批(将标准的12个月的审批过程缩短为6个)。
FDA批准Kazia Therapeutics的paxalisib药物罕见儿科疾病指定
Kazia Therapeutics (ASX: KZA)因其主导药物paxalisib治疗弥漫性内源性桥脑胶质瘤(DIPG)被FDA授予罕见儿科疾病指定奖(RPDD)。 RPDD地位意味着Kazia现在有资格获得一个所谓的“罕见的儿科疾病优先评审券”(减压阀)——可专卖的的加速6个月的审查与FDA新药应用程序——如果paxalisib批准治疗DIPG,一种罕见的和高度攻击性儿童脑癌。 Kazia在最近几周发表了几篇关于paxalisib治疗最常见和最具侵袭性的原发性脑癌胶质母细胞瘤的正面报道。 与此同时,2018年10月,在孟菲斯的圣犹大儿童研究医院开始了使用该药物治疗DIPG的第一阶段试验,并于2019年公布了令人满意的顶级安全数据。 该研究现已完成招募,初步疗效数据预计将于今年晚些时候公布,为今后paxalisib的开发提供指导。 商业化paxalisib 除了胶质母细胞瘤和DIPG之外,paxalisib对不同类型脑癌的研究也在进行中。 Kazia预计在今年剩余时间内获得其他试验的初步疗效数据。 在6月给美国癌症研究协会(AACR)的报告中,Kazia透露了正在进行的paxalisib治疗胶质母细胞瘤的2期研究的中期分析。该公司表示,其研究确定了接受帕罗昔立b治疗的患者的中位总生存期为17.7个月,而历史对照组接受替莫唑胺治疗的患者的中位总生存期为12.7个月,后者是现有的治疗标准。 Kazia表示,该公司在胶质母细胞瘤研究方面收到了“近几个月非常积极的数据”,该药物“正按计划”启动注册的第三期研究,目前还在进行资金讨论。 Kazia的首席执行官James Garner博士表示,Kazia希望“在未来几年内”进入这个市场。 根据GlobalData发布的一份报告,尽管目前的发展趋势是解决未被满足的需求,但分析师估计,胶质母细胞瘤的市场规模将超过每年15亿美元,而这些需求在很大程度上“受到临床开发困难的阻碍”。 RPDD程序 2012年,FDA将RPDD项目纳入其运作,通过向私营制药公司提供激励措施,进一步开发治疗严重和危及生命的罕见儿科疾病的药物。 典型的是,患有RPDD的药物被批准用于治疗影响年幼儿童的疾病,在美国,这些疾病的年发病率低于20万,而且严重或危及生命。 Kazia称,在这种罕见的儿科疾病获得上市许可时,PRV代表了“最重要的”激励因素,并引用了过去PRV以“数千万至数亿美元”的价格出售的案例。 PRV有效地将FDA对任何药物未来上市申请的审查期从12个月缩短到6个月,Kazia乐观地认为,它有可能将PRV转移到一家推出10亿美元药物的大公司。 “对于诊断为DIPG的患者,目前没有FDA批准的药物治疗,诊断后的平均生存期约为9.5个月,”Garner博士说。 FDA批准RPDD认可了我们迄今为止的努力和成就,这使我们能够将paxalisib作为DIPG的潜在疗法向前推进。我们继续受到该领域合作者的奉献精神的鼓舞,并致力于了解paxalisib是否能够帮助这个具有巨大挑战的儿科疾病。” 此外,不久之后,paxalisib可能会得到其他应用。 Garner博士说:“尽管我们对paxalisib的主要研究对象仍是胶质母细胞瘤,但我们也一直在投入越来越多的精力开发用于治疗儿童脑癌的药物。”