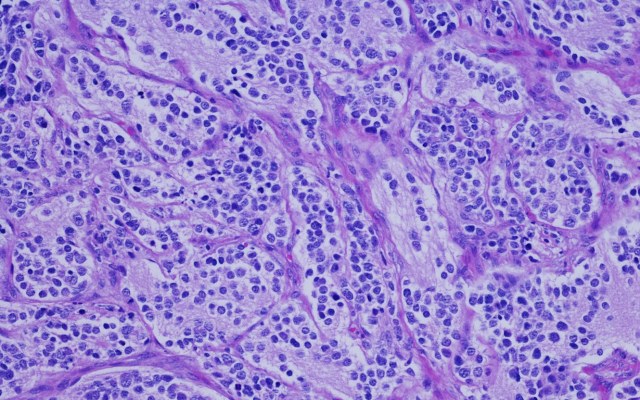
日前,Amplia Therapeutics (ASX: ATX)完成了局灶黏附激酶(FAK)抑制剂药物AMP945的生产,离胰腺癌和肺纤维化的2期临床试验又近了一步。 该公司的承包商在预算范围内按时完成了2公斤AMP945的GMP运行。 Amplia指出,之前的批次尺寸为1kg,这意味着生产规模已经翻了一番,同时符合GMP条件。 Amplia首席执行官John Lambert博士表示:“AMP945临床级的生产能力成功增加了一倍,并实施了生产改进,这是杰出的成果,超出了我们最初的预期。” 他补充说:“这些改进不仅为我们的近期开发项目提供了材料,而且为APM945数据包奠定了坚实的基础,这将是未来监管应用及其商业发展所必需的。” FAK抑制剂 根据Amplia的研究,FAK与许多癌症防御机制有关,这些机制可以降低抗癌治疗的效果。 癌症中FAK水平高通常与不良结果有关。 Amplia开发了AMP945,这是一种FAK抑制剂,可以破坏癌症防御,使疾病对化疗和其他药物治疗更有反应。 本季度开始第二阶段试验 Amplia将在其二期临床试验中使用AMP945治疗胰腺癌患者。审判将于本季度开始。 在即将进行的试验中,AMP945将与化疗药物吉西他滨和Abraxane联合使用。吉西他滨和Abraxane是目前新诊断胰腺癌患者的护理标准。 胰腺癌是最致命的恶性肿瘤之一,5年生存率为5-10%。 除了胰腺癌试验,Amplia还将在纤维化肺病患者中开展AMP945研究。 该公司将于下月开始为期三个月的延长毒理学研究,这将用于支持试验。
Tag: ATX
Amplia Therapeutics获得210万澳元的拨款,用于快速开发第二种抗癌药物AMP886
制药公司Amplia Therapeutics (ASX: ATX)获得了210万澳元的政府资助,以加快其第二种局灶粘附激酶(FAK)抑制剂AMP886的工作,用于治疗癌症和纤维化疾病。 该公司根据维多利亚州政府的研究及发展现金流动贷款计划,申请二百一十万澳元的设施。 这笔资金将分两部分发放给Amplia,首批130万澳元预计将于本月发放,其余80万澳元将于明年3月底前发放。 Amplia将利用这笔资金快速开发AMP886,包括评估该药物的新治疗机会和启动临床前活动,以支持未来的临床试验。 Amplia首席执行官兼董事总经理John Lambert博士表示:“这笔贷款使我们能够比原计划更早、更积极地启动第二个资产AMP886的工作。” FAK抑制剂 该公司表示,FAK是治疗癌症和纤维化的一个“越来越重要的靶点”。 FAK与许多癌症防御机制有关,这些机制会降低抗癌药物的有效性。 癌症中FAK水平升高通常与不良预后相关。 Amplia正在开发FAK抑制剂,以破坏癌症防御机制,使其对化疗和其他药物治疗更敏感。 AMP886目前处于临床前阶段,该公司正在开发它作为唯一的治疗方法。 先进的铅药物AMP945 Facility funds也将用于扩大Amplia的领先FAK抑制剂AMP945的抗纤维化潜力的研究范围。 这种药物目前正被开发用于协助治疗胰腺癌。 Lambert博士说,AMP945的二期临床研究已经得到资助,将于明年年初开始。 这项研究将评估在吉西他滨和Abraxane联合化疗中加入AMP945,后者是目前用于新诊断胰腺癌患者的护理标准。 为了协助研究,Amplia在10月获得了著名的肿瘤药物开发专家José Iglesias博士作为临床顾问。
Amplia Therapeutics证实抗癌药物AMP945可以抑制健康志愿者的局灶黏着激酶
澳大利亚制药公司Amplia Therapeutics (ASX: ATX)最近获得了一项一期临床试验的新数据,该试验证明了先导药物AMP945作为口服胶囊在健康人体志愿者中抑制局粘连激酶(FAK)的能力。 该试验在墨尔本Nucleus Network进行,旨在通过评估不良事件的性质、发生率和严重程度、戒断、体检、生命体征,建立AMP945的安全性、耐受性和药动学。心电图(ECGs)和实验室测试结果,包括生化和血液标记的评估。 收集了56名健康志愿者的皮肤活检,这些志愿者分别服用了单剂量或多剂量的AMP945(分别高达125毫克和100毫克)或安慰剂,以评估药物抑制人体组织中FAK的能力。 为研究食物对药物吸收的影响,一组受试者在进食前后分别给予AMP945。 敏感试验 样品的分析需要Amplia开发一种敏感的分析方法,该方法可以在给药前后测量皮肤样品中的活性形式FAK(磷酸FAK或pFAK)。 结果表明,口服AMP945可导致活性pFAK的降低,并且FAK抑制的程度与药物水平相关。 这些数据将用于进一步完善AMP945的剂量水平,用于胰腺癌患者的2期临床试验。 它还将为计划于2022年末对AMP945进行肺纤维化的调查提供指导。 下一阶段的试验 Amplia首席科学官Dr Mark Devlin很高兴第一阶段的数据可以支持下一阶段的临床试验,并表示新的检测方法已经被证实是指导剂量选择的一种测试方法。 他说:“我们在动物模型中观察到AMP945对FAK的抑制作用,这与抗肿瘤和抗纤维化活性有关……能够在人类志愿者中观察到(相同的反应)是拼图的重要部分。” “在我们的第一阶段试验中获得如此清晰和引人注目的FAK抑制数据是非常令人高兴的,并且为我们开始在患者中试验AMP945提供了额外的安慰。” Dr Devlin说,对第一阶段试验的主要、次要和探索性终点的审查证实,该药物在所有测试剂量下都是安全且耐受性良好的。 它还展示了“优异的药代动力学特性”,使其适合每日一次口服给药,并能够与预期的FAK靶点结合。
Amplia Therapeutics聘请著名肿瘤药物开发专家担任临床顾问
Amplia Therapeutics (ASX: ATX)已任命Dr José Iglesias为胰腺癌治疗的临床顾问,协助其癌症和肌瘤药物的开发。 该公司指出,Dr Iglesias负责开发Abraxane,这是目前晚期胰腺癌治疗标准的基石。 该药物也是Amplia的局灶粘连激酶抑制剂AMP945治疗的首个临床适应症。 Amplia表示,让Iglesias博士担任临床顾问将能获得他的“广泛经验”,并协助开发新的肿瘤药物。 Dr Iglesias在制药行业有超过30年的经验,专注于开发新的肿瘤药物。 Amplia首席执行官兼董事总经理John Lambert表示:“Dr Iglesias在肿瘤新药临床开发方面的丰富经验将对我们明年年初开始在胰腺癌患者中开展AMP945二期临床试验具有重要意义。” “Dr Iglesias在领导当前医疗标准发展方面的丰富经验,我们计划将AMP945加入其中,这将特别相关,并将极大地增强我们进行试验和解释紧急临床数据的能力。” 急需胰腺癌治疗 在谈到他在Amplia的新角色时,Dr Iglesias表示,他“非常高兴”能够从事治疗胰腺癌的“令人兴奋的新方法”的研究。 他指出,胰腺癌仍然是一种“毁灭性的”和“管理不善的”疾病,“迫切需要”新的治疗方法,包括Amplia的AMP945。 胰腺癌是最致命的癌症之一,5年生存率为5-10%。 唯一可能的治疗方法是手术切除,但只有20%的患者符合这一条件。其余患者要么患有局部不可切除的疾病,要么患有转移性疾病。 不能进行手术的患者的一线治疗是使用吉西他滨/Abraxane或FOLFIRINOX化疗。 此外,只有40-50%的一线患者能够接受二线治疗,目前还没有针对二线患者的标准治疗方法。 Amplia正在开发FOK抑制剂,以破坏癌症防御机制,并使癌症对药物更敏感。
Amplia Therapeutics获得114万澳元的抗癌药物研发费用退税
临床开发公司Amplia Therapeutics (ASX: ATX)从联邦政府获得了一项研发税收优惠退款,用于推进其用于癌症和纤维化疾病的局灶黏附激酶(FAK)抑制剂的支出。 该公司在2020/2021财年获得114万澳元,用于支付其高效选择性抑制剂药物AMP945和AMP886的开发费用。 具体来说,这笔回扣涉及一项AMP945一期临床试验及相关准备工作,该项目已于今年上半年完成。 安全性和耐受性 第一阶段试验在墨尔本Nucleus Network进行,共有56名健康志愿者参与,通过评估不良事件、停药、体格检查、生命体征、心电图(ECGs)和安全实验室测试结果的性质、发生率和严重程度,关注AMP945口服胶囊的安全性和耐受性。包括生化和血液指标。 志愿者接受单剂量(最多125毫克)或多剂量(最多100毫克,每天一次,连续7天)的药物。 研究发现,该药物在所有剂量下均具有良好的耐受性,没有记录停药或不良事件。 同样,与AMP945相关的生命体征、临床或实验室参数没有显著变化,在任何测量参数中均未检测到不良安全信号或剂量相关趋势。 Amplia董事总经理Dr John Lambert当时评论说,该试验“提供了我们想要的结果”。 目前正在设计一项二期临床试验,在接受胰腺癌一线治疗的新诊断患者身上测试AMP945。 AMP886研究 在不同的研究路径上,Amplia正在进行非临床研究,以评估AMP886的全部潜力,该药物也抑制其他两个已证实的疾病靶点。 研究将包括对不同癌症和纤维化疾病的一系列动物模型进行进一步评估,以确定发展、合作和许可机会。
Amplia Therapeutics说,“启动”肿瘤可以改善胰腺癌患者的预后
美国Amplia Therapeutics公司(ASX: ATX)计划在胰腺癌患者身上进行的2期临床试验的基础生物学研究强调了在给予标准化疗前使用局灶黏附激酶(FAK)抑制剂的潜在益处。 这项研究由Garvan Institute of Medical Research发表,由在Garvan研究FAK生物学的Professor Paul Timpson领导,他是Amplia科学顾问委员会的成员。 Professor Timpson的团队能够证明,植入人类胰腺癌组织的小鼠可以使用FAK抑制剂(或“启动剂”)进行预处理,以增加肿瘤对随后实施的一线吉西他滨化疗的反应性。 这种抑制剂可以通过降低间质结缔组织的硬度和密度来增强肿瘤对化疗的反应,并减少50%的癌症扩散。 FAK引物还减少了肿瘤细胞向肝脏等次要部位的转移扩散。 新方法 Amplia首席执行官John Lambert说,这种启动肿瘤环境的新方法可能会提高化疗治疗胰腺癌的效果。 他说:“在过去的两年里,已经有一些出版物强调了FAK抑制剂在胰腺癌中的潜力,包括它们与化疗药物协同工作的能力。” “我们在Garvan的合作者的这项最新研究特别令人兴奋,因为它复制了我们在2期试验中治疗一线胰腺癌患者的方法。” 改善结果 Professor Timpson说,这项研究为改善病人的预后提供了一个有希望的方法。 他说:“通过使用FAK抑制剂对肿瘤进行预处理,我们正在改变癌细胞周围基质组织的硬度以及数量和沉积。” “在这种更柔软的表面上,癌细胞变得停滞不前,使它们对化疗更加敏感[因此]有效,我们正在增加这些细胞对化疗的脆弱性窗口,在我们的模型中减少胰腺癌的生长和扩散。” 他说,这项工作是实验室前沿研究的一个“强有力的例子”,有助于与工业界建立合作关系,并有可能实现临床转化。 癌症诊断 在美国,每年约有6万人被诊断患有胰腺癌,在澳大利亚则有近4000人被诊断患有胰腺癌。 它被认为是最致命的癌症之一,5年生存率在5%到10%之间。 唯一可能的治疗方法是手术切除,但只有20%的患者有资格接受手术,其余患者要么是局部的、不可切除的(不能用手术治疗),要么是转移性疾病。 对于这些患者,标准的一线治疗方法是使用吉西他滨或联合用药Folfirinox(也用于治疗肠癌)进行化疗。 大约50%的一线胰腺癌患者能够接受二线治疗,但目前还没有标准的治疗方法。
Amplia Therapeutics完成了治疗晚期胰腺癌的2期AMP945试验的设计
澳大利亚制药公司Amplia Therapeutics (ASX: ATX)完成了其局灶黏附激酶(FAK)抑制剂AMP945的2期临床试验设计,用于治疗晚期胰腺癌。 该设计基于悉尼加文医学研究所(Garvan Institute of Medical Research)在胰腺癌动物模型上进行的研究,这些研究表明,间歇性剂量的AMP945可以使肿瘤对标准化疗更有反应。 主要终点将基于与历史对照相比的治疗的客观缓解率。 在次要和探索性终点将评估多种其他疗效信号,包括反应持续时间、疾病进展率、生存率和对疾病生物标志物的影响。 最近确诊病人 Amplia的试验(指定为AMP945-202)将招募接受一线治疗的澳大利亚新诊断患者,并将进行两个阶段的开放标签单臂锻炼。 在第一阶段,将选择最佳剂量的AMP945,并对大约40名患者进行初步疗效评估。 在第二阶段,多达24名额外的患者将被招募,以增加对初步结果的信心。 在使用吉西他滨+白蛋白-紫杉醇的晚期胰腺癌标准护理化疗之前,AMP945将被口服给药。 所有患者预计将接受多轮治疗。 加快招聘 Amplia首席执行官Dr John Lambert表示,一线患者的使用有望加快招募,并提供最佳机会来检测从加入AMP945到化疗的任何疗效信号。 他说:“作为胰腺癌一线治疗的一部分,AMP945的临床评估显著降低了我们项目的风险,并使该药物与更大的患者基础相关。” “我们最近的一期临床试验显示,AMP945具有良好的安全性和耐受性,这使得在这种环境下测试AMP945成为可能。” 致命的癌症 在美国,每年约有6万人罹患胰腺癌,在澳大利亚则有近4000人罹患胰腺癌。 它被认为是最致命的癌症形式之一,症状的细微之处意味着在它扩散到原来的部位之前,通常无法确诊。 目前,胰腺癌唯一可能的治疗方法是手术切除;然而,只有大约20%的患者有资格接受手术治疗,其余的患者要么是局部的、不可切除的(不能通过手术切除),要么是转移性疾病。 对于这些患者,标准的一线治疗是化疗,只有不到50%的患者会继续接受二线治疗,而二线治疗没有标准治疗方法。 Dr Lambert说:“晚期胰腺癌患者的治疗选择非常有限,对具有新作用机制的新疗法的需求尚未得到满足。” “如果我们能够看到积极的迹象,AMP945改善了目前领先的治疗选择,我们将开始与监管机构和潜在合作伙伴讨论支持产品批准所需的未来试验。”
Amplia Therapeutics 为股东支持的第二阶段 AMP945 试验做准备
Amplia Therapeutics (ASX: ATX)将于9月完成其先导药物AMP945在胰腺癌和特发性肺纤维化(IPF)患者中的二期临床试验设计。 这项工作得到了5月份完成的380万澳元融资的支持,在此之前,第一阶段试验的成功表明,该药物在所有测试剂量下都是安全且耐受性良好的。 这家澳大利亚制药公司旨在开发癌症和纤维化的新疗法,今天发布了截至2021年6月的三个月的活动和现金流报告。 Amplia首席执行官兼董事总经理Dr John Lambert表示,公司上季度的进展使其处于下一阶段临床开发的有利地位。 “我们上周宣布的成功一期临床试验的结果证实,AMP945具有一定的特性,这使得它非常适合进入胰腺癌和IPF患者的二期临床试验。” 他补充说,上一季度筹集的新资金将有助于公司为今年晚些时候启动第二阶段临床项目做准备。 他表示:“Amplia非常感谢新老股东给予的支持。” 该公司还在本季度末之前与悉尼的加文医学研究所(Garvan Institute of Medical Research)达成了合作协议。 Dr Lambert表示,该合作伙伴关系已经提供了宝贵的数据,验证了Amplia的策略,即“将AMP945添加到现有的标准护理疗法中,以提高目前胰腺癌患者的不良反应”。 第二阶段临床试验计划 Amplia公司表示,AMP945在胰腺癌患者中的第二阶段试验计划“进展良好”,其设计预计将在本季度完成。 该公司已经聘请了一系列临床医生、监管和生物统计顾问和其他专家来协助这一过程,并将他们的建议纳入试验的设计。 Amplia还开始了AMP945的大规模生产和更长期的动物毒理学研究,以支持IPF的第二阶段试验,该试验计划于2022年年中开始。 与此同时,该公司计划继续对AMP945和另一种候选药物AMP886进行非临床研究,以扩大数据集,支持这些药物在其他治疗领域的潜在应用。 研发支出将会减少 Amplia在上一季度的运营支出为134万澳元,其中93.3万澳元用于研发,主要用于完成AMP945的一期临床试验。 随着第一阶段试验的招聘工作结束,该公司预测,9月当季的研发成本将会下降。 截至6月当季,该公司持有408万澳元现金。
Amplia Therapeutics的1期研究结果支持AMP945在癌症和纤维化中的发展
制药公司Amplia Therapeutics (ASX: ATX)近日公布了一项一期临床试验的无盲结果,为进一步开发用于癌症和纤维化的药物AMP945提供支持。 该结果证实了该公司的初步分析,并表明该药物在试验中测试的所有剂量下都是安全的,耐受性良好。 Amplia公司的首席执行官兼董事总经理John Lambert博士说,这项试验正是该公司所希望的。 他说:“AMP945已被证明具有安全性和耐受性,适合将其推进到胰腺癌和肺纤维化的二期试验。” Dr Lambert表示,胰腺癌二期试验预计将在“2021年底左右”开始。 第一阶段结果 Amplia的临床试验是一项单次和重复剂量AMP945的安全性和药代动力学的第一阶段随机、双盲、安慰剂对照研究。 这项研究是在2020年9月由阿尔弗雷德医院人类研究伦理委员会(HREC)批准的协议协议下进行的。 其主要终点是口服AMP945的安全性和耐受性。次要终点评估药物的药代动力学。 共有56名年龄在18-65岁之间的健康成人志愿者接受了单剂量(125毫克)或多剂量(100毫克)AMP945或安慰剂的剂量(通过胶囊与一杯水一起服用)。连续7天,每天服用多次剂量。为了研究食物对药物吸收的影响,一组受试者在进食前和进食后均给予AMP945。 据该公司称,研究结果显示,AMP945在所有剂量下耐受性良好,在试验中没有出现停药或严重不良事件的记录。不良事件“一般是轻度或中度的”,并且在参与者中平均分布。 最常见的不良事件是轻度头痛,被认为“可能”与AMP945相关的事件包括1例腹泻、2例头痛、1例味觉障碍和1例潮热。 口服给药后,AMP945的血浆半衰期约为20小时,说明该药物既可口服生物利用度,也可每日给药1次。 AMP945的血浆水平超过了抑制预期目标-黏附激酶(FAK)所需的浓度,在给药后约2 – 4小时达到最高血浆水平。 没有证据表明食物对药物的吸收有任何影响。正在进行的研究是测量AMP945在皮肤穿孔活检中对FAK的抑制活性,并评估该药物的血浆代谢物谱。
Amplia Therapeutics与Garvan Institute合作开发胰腺癌药物
近日,澳大利亚制药公司Amplia Therapeutics (ASX: ATX)与悉尼Garvan医学研究所达成协议,合作开发用于治疗胰腺癌患者的药物AMP945。 这家总部位于墨尔本的公司专注于开发治疗癌症和纤维化的新方法,包括开发如AMP945等焦粘激酶(FAK)抑制剂的管道。 今年3月,该公司与Garvan签署了一份最初的投资意向书。该协议定义了正在进行的合作研究和临床开发项目的结构。 通过此次合作,Amplia将获得Garvan广泛的临床研究网络,并受益于其在FAK生物学方面的研究实力。 计划阶段的第二阶段临床试验 此前,Amplia在Garvan进行了非临床研究,以评估AMP945抑制纤维化的能力,并显著提高侵袭性胰腺癌动物模型的存活率。 Amplia首席执行官兼董事总经理Dr John Lambert说:“我们已经从今年早些时候公布的非临床研究结果中看到了这种合作的好处。” “这些研究为AMP945的生物学特性提供了重要的见解,并进一步证实了我们的决定,将这种有前途的药物推进到胰腺癌患者的第二阶段临床试验。” 这项早期研究的结果将纳入计划于今年晚些时候开始的第二阶段试验的设计和规划中。 合作条款 Amplia与Garvan的合作最初期限为两年,Amplia将获得参与FAK抑制剂与其他治疗产品联合治疗癌症相关研究项目的优先权。 最终合作协议的条款还规定了扩展到其他治疗领域。 根据研究和许可协议,Amplia已同意资助使用AMP945联合吉西他滨(在商标Abraxane下注册)治疗癌症的研究,最初的重点是胰腺癌。Amplia将获得合作产生的新知识产权的优先权利。