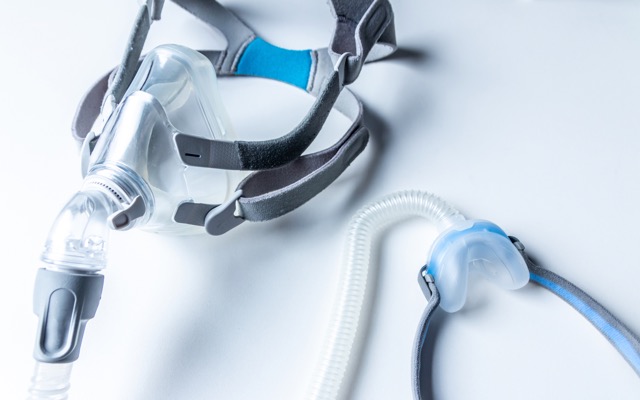
处于临床阶段的制药公司 Incannex Healthcare(ASX:IHL)针对 150 亿美元的睡眠呼吸暂停市场开发的新产品获得批准,这是该公司取得的又一个里程碑。 该公司已向美国食品药品管理局(FDA)成功提交了其独特的 IHL-42X 新药研发(IND)申请,相信该产品能缓解与阻塞性睡眠呼吸暂停治疗相关的许多问题。 目前,治疗睡眠呼吸暂停的主要方法是持续气道正压疗法(CPAP)。对许多人来说,晚上使用 CPAP 机器太不舒服了。 CPAP 是将面罩绑在人的脸上,面罩与软管和气泵相连,当人试图入睡时,气泵会将加压的空气送入人的口鼻中。 更简单的治疗 Incannex 公司的 IHL-42X 疗法采用屈大麻酚(一种合成的四氢大麻酚(THC))和乙酰唑胺(一种碳酸酐酶抑制剂)的组合剂量。 早些时候的一项二期概念验证临床试验结果显示,与基线评估结果相比,IHL-42X 可使呼吸暂停-低通气指数(AHI)平均降低 50.7%,25% 的参与者的 AHI 降低幅度超过 80%。 重要的是,临床试验期间未报告严重的治疗不良事件,而且在夜间用药后的第二天早上,血液中的四氢大麻酚水平低于驾驶能力受损的限度。 下一组试验 Incannex 现已向 FDA 提交了 IND 档案,该档案由 IHL-42X 及其活性药物成分的安全性和有效性综合模块组成。 它还包括有关 IHL-42X 药物产品的开发、生产、质量和稳定性的详细信息,以及 2/3 期 IND 开放临床试验的临床方案和研究人员信息。 Incannex 公司董事总经理兼首席执行官 Joel Latham 说,向FDA提交IND对于公司获得监管部门批准、开展临床试验以及与FDA进行科学对话至关重要,同时也是公司在美国推进研究药物开发阶段的关键。 “FDA对IND申请的审查过程包括对科学、临床和安全方面的评估,以确保拟议的临床试验符合监管要求。” 公司提交的 IND 文件包括关键 IND 开放临床试验的临床试验方案细节。 这将是一项多站点 2/3… Continue reading Incannex 向美国FDA提交重要申请,以开拓价值 150 亿美元的睡眠呼吸暂停市场
Tag: IHL
Incannex Healthcare 聘请 Fortrea 管理阻塞性睡眠呼吸暂停的 2/3 期 IHL-42X 试验
Incannex Healthcare (ASX: IHL) 已聘请全球公司 Fortrea 作为合同研究组织,负责管理其在研新药开放 2/3 期临床试验,研究 IHL-42X 治疗阻塞性睡眠呼吸暂停的效果。 该试验将评估 IHL-42X 在最近一项概念验证临床研究中表现最佳的两种剂量的安全性和有效性,该研究针对的是不耐受、不依从或未接受气道正压通气的患者。 参与者将在 52 周的治疗期内接受一剂 IHL-42X、屈大麻酚、乙酰唑胺或安慰剂。 他们将完成每日睡眠质量调查,并每月参加诊所访问,以评估睡眠的功能结果、认知功能和其他安全性和有效性指标。 每三个月进行一次夜间多导睡眠监测,以确定 IHL-42X 治疗对每位患者呼吸暂停低通气指数 (AHI) 评分的影响。 积极的结果 Incannex 董事总经理 Joel Latham 表示,概念验证试验取得了积极的结果。 “结果表明,我们的主要终点 AHI 平均降低了 50.7%,其中 25% 的受试者 AHI 降低了 80% 以上,”他说。 “重要的是,我们观察到患者平均氧饱和度指数降低了 59.7%,睡眠质量显着改善,心血管压力降低……结果确实非常显着,使这项 2/3 期试验成为真正的长期试验 安全性和有效性试验。” Latham 先生表示,如果新试验能够证明类似的结果,将增强人们对 IHL-42X 市场潜力的信心。 可行性研究 Fortrea 此前曾受 Incannex 委托开展一项为期 12… Continue reading Incannex Healthcare 聘请 Fortrea 管理阻塞性睡眠呼吸暂停的 2/3 期 IHL-42X 试验
Incannex Healthcare获得HREC批准,用于类风湿性关节炎患者的IHL-675A II期临床试验
药用大麻素和迷幻疗法开发公司 Incannex Healthcare (ASX: IHL) 已获得 Bellberry 人类研究伦理委员会 (HREC) 的批准,在澳大利亚维多利亚 Emeritus Research 场所开展候选药物 IHL-675A 的 2 期临床试验。 该关键试验将评估 IHL-675A 作为专有抗炎组合药物用于类风湿关节炎患者的安全性和有效性。 它遵循动物研究观察结果,IHL-675A 比硫酸羟氯喹 (HCQ) 能更大程度地显着降低炎症性疾病评分,后者是一种长期存在的治疗类风湿性关节炎的常见处方药(称为“Plaquenil”),具有相当大的市场知名度。 Incannex 希望 IHL-675A 在这项广泛的 2 期疗效试验中的观察结果中继续优于 Plaquenil。 该试验将利用 24 周内患者报告的结果、疾病评分和炎症生物标志物分析来评估 IHL-675A 对疼痛和功能的影响。 它将包括一项通过 MRI(磁共振成像)检查关节损伤的子研究。 将根据筛选时的类风湿性关节炎 MRI 评分 (RAMRIS) 评估患者参加子研究的资格。 试用管理 该试验将由澳大利亚和美国合同研究组织 Avance Clinical 管理,该组织将在澳大利亚和新西兰的多达 10 个地点进行试验,并招募总共 128 名在接受类风湿性关节炎稳定治疗期间持续疼痛和功能减退的患者。 患者将被随机分配到 IHL-675A、单独 CBD、单独… Continue reading Incannex Healthcare获得HREC批准,用于类风湿性关节炎患者的IHL-675A II期临床试验
Incannex Healthcare寻求在NASDAQ独家上市,以扩大视野
澳大利亚制药大麻产品开发商Incannex Healthcare (ASX: IHL) (NASDAQ: IXHL)宣布有意搬迁到美国,并计划最终从ASX退市。 该公司选择在NASDAQ上市,因为它相信美国市场更容易接受制药项目。 Incannex董事总经理兼首席执行官Joel Latham说,纳斯达克上市的比较公司的市场估值要高得多,这一变化使公司能够扩大到更广泛的投资者群体。 Latham表示:“这是一个旨在实现股东价值最大化的决定。” “Incannex在澳大利亚证券交易所已经成熟,拥有庞大而多样化的药物组合,两种令人兴奋的候选药物即将进入关键的临床试验。通过在美国开展业务,我们相信我们公司在国际投资者中的知名度将显著提高,部分原因是我们的价值主张与在北美开展业务的类似新兴生物技术公司相比。” 该公司还认为,重新注册可能会改善在更大、更多样化的美国市场获得低成本股权资本的渠道。 更改位置图 地点的变更将根据拟议的Incannex与其股东和期权持有人之间的安排方案完成。 该计划的批准将需要获得公司股票和期权持有人的批准,以及其他监管机构和法院的批准。 公司已获得美国证券交易委员会 (SEC) 的注册,并已获得纳斯达克全球市场上市资格。 预期的股东和期权持有人投票预计将在10月份举行。 美国投资者需求增长 Incannex在美国有American Depository Receipts (ADR)交易,但它们是打包证券,不是完全的美国股票。目前,只有一小部分Incannex公司股票以ADR的形式在美国交易,但近期交易量有所上升。 Latham表示:“在与美国投资界接触了18个月之后,Incannex见证了投资者需求的增长,这一点在7月6日得到了证明,当日IXHL adr的交易量相当于1.6亿股IHL股票。” 为向美国投资者提供流动性而重新注册 “在美国,以美国存托凭证形式进行的证券交易不到1.5%,这对投资者在我们公司的投资头寸构成了限制。很少有澳大利亚经纪商可以交易美国存托凭证,然而,大多数在线交易平台为直接交易美国股票提供了便利。” “让公司持有的所有Incannex股票在纳斯达克交易,将有助于形成一个有凝聚力的单一市场,并达到美国投资银行预期的适当流动性水平,其中一些投资银行已开始启动对Incannex进行独立研究的程序。” 在重新注册之前,Incannex已与在特拉华州注册成立的新美国公司Incannex Healthcare Inc. (Incannex US)签订了Scheme Implementation Deed (SID)。 Incannex US最终将成为Incannex集团公司的最终母公司,IHL将成为Incannex US的全资子公司。 根据拟议的股份计划,在股份计划的记录日期,每持有100股Incannex股票,持有全额支付的Incannex普通股的持有人将有权获得1股Incannex美国普通股。 美国市场有望大幅增长 专家市场研究(EMR)估计,到2020年,美国医用大麻产业的价值约为92亿美元。该市场预计将以46.5%的复合年增长率增长,到2026年将达到243亿澳元左右。 市场分析人士表示,该地区的人口老龄化在提高医用大麻市场方面发挥了重要作用,因为老年患者更容易患上慢性病,需要更多的医生就诊。预计临床试验、研发和基于大麻的适应症的商业化也将成为市场增长的催化剂。 EMR表示,尽管在健康产品上的支出不太可能波动,但医用大麻的使用受到可支配收入不寻常变化的影响。因此,较高的可支配收入将对医用大麻需求产生积极影响。
Incannex获批进行IHL-42X治疗阻塞性睡眠呼吸暂停的药代动力学和耐受性临床试验
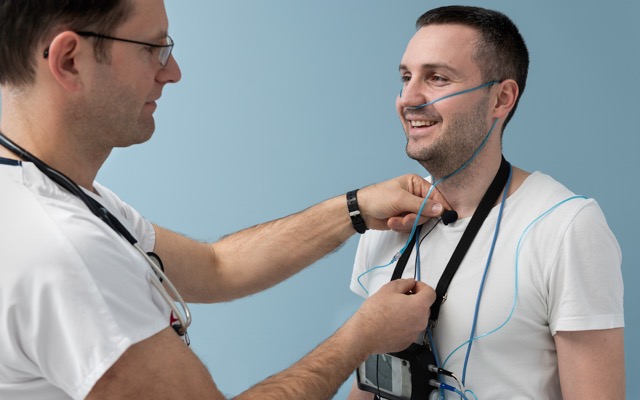
临床阶段制药公司Incannex Healthcare (ASX: IHL)已获得Bellberry人类研究伦理委员会的批准,开始生物利用度/生物等效性(BA/BE)临床试验,以评估主要候选药物IHL- 42x治疗阻塞性睡眠呼吸暂停(OSA)的药代动力学和耐受性。 该试验将由临床合同研究组织Novotech管理,并在南澳大利亚的CMA Clinical Research进行。 它的目的是评估活性药物成分(API),将四氢大麻酚(tetrahydrocannabinol, THC)和乙酰唑胺与各自的美国食品和药物管理局参考上市药物进行比较。 并将测试食物对两种原料药药代动力学的影响。 在试验过程中,116名参与者将分别在禁食条件下完成IHL-42X、曲大麻酚和乙酰唑胺的四种单剂量治疗,并在进食条件下完成IHL-42X治疗。 将在48小时内收集所有参与者的血液样本,并分析样本中api和主要代谢物的浓度。 试验设计 Incannex表示,该试验的设计与FDA的建议和从药物开发前研究新药(IND)过程中收到的具体建议一致。 该试验的结果有望成为未来新药申请的关键组成部分,为参考上市药物提供必要的桥梁,并促进历史安全性数据的使用。 该公司表示,该试验将与一项关键的2/3期研究并行进行,该研究将在向FDA提交IND申请后开始。 前进 Incannex的首席科学官Mark博士很高兴能够推进这项试验。 “Bellberry的这项研究的批准使我们能够与CMAX和Novotech一起进行患者招募和数据收集,”他说。 “我们希望能够将历史安全性数据与曲大麻酚和乙酰唑胺的参考药物列表连接起来,这将加速该药物的开发,并降低我们的成本和时间表。” 阻塞性睡眠呼吸暂停 阻塞性睡眠呼吸暂停是世界上最常见的与睡眠有关的呼吸障碍之一。 它涉及睡眠时上呼吸道变窄,从而干扰人的呼吸,减少氧气的摄取,导致睡眠质量差。 未经治疗的阻塞性睡眠呼吸暂停会导致长期的不良健康结果,包括高血压、心血管疾病、心脏病发作、认知障碍、焦虑和抑郁、易怒和白天疲劳。 目前还没有治疗阻塞性睡眠呼吸暂停的药物。
Incannex为睡眠呼吸暂停试验做出重要预约
Incannex Healthcare (ASX: IHL)在其研究中又迈出了关键一步,以帮助改善数百万睡眠呼吸暂停患者的舒适度,并摧毁数十亿澳元的医疗设备行业。 这家处于临床阶段的制药公司正准备对一种大麻素药物产品进行下一阶段的测试,该公司认为,这种产品可以减少许多用户目前为了安全而佩戴的昂贵且不舒服的医疗设备的使用,并改善睡眠习惯。 阻塞性睡眠呼吸暂停 (OSA) 发生在一个人在夜间呼吸暂停时,因为他们的喉咙在睡觉时部分或完全阻塞了一小段时间。 在大多数严重睡眠呼吸暂停的病例中,医生会推荐CPAP (Continuous Positive Airway Pressure) 治疗,或其他患者可能觉得麻烦且影响睡眠的口腔设备。 数十亿澳元的市场 目前,全球睡眠呼吸暂停设备市场的收入预计到2023年将达到58亿美元(84亿澳元),到2028年将达到80亿美元(116亿澳元),从2023年到2028年的复合年增长率为6.5%。 总部位于墨尔本的Incannex公司开发了一种新型的、药丸形式的、用户友好的治疗方法,名为IHL-42X,已经在早期试验中显示出希望。 为了准备关键的下一阶段,该公司已经引进了两位备受推崇的首席研究员 (PI) 进行Investigational New Drug Application (IND)开放的2/3期临床试验,以进一步研究IHL-42X作为呼吸暂停治疗的作用。 丰富的研究经验 Incannex首席执行官兼董事总经理Joel Latham说,这两位任命是来自德克萨斯州奥斯汀的FutureSearchTrials of Neurology 的John Hudson博士和来自佐治亚州亚特兰大的神经试验研究的Russell Rosenberg博士,他们是各自领域的两位领导者。 在过去的20年里,Hudson博士监督了300多项临床试验,其中大部分与神经和睡眠障碍有关,并且一直是这些疾病的国内和国际演讲者。 Rosenberg博士在临床睡眠医学和研究方面拥有超过35年的经验,曾担任300多项临床试验的调查员,其中包括14项睡眠呼吸暂停试验和211项其他睡眠相关疾病试验 他是一名经过认证的American Academy of Sleep Medicine会员,罗森博格博士是美国 National Sleep Foundation (NSF)的前主席和发言人,并经常出现在地方和国家电视新闻节目中,包括《Today Show》、《Good Morning America》、CNN和MSNBC。 另一个关键步骤 Latham表示,招募首席研究人员是IND启动2/3期研究的关键一步。 主要研究人员专注于神经,疼痛和睡眠障碍治疗的临床研究,其特点是使用现场睡眠实验室。 “我们公司很高兴得到两位具有相关经验的知名研究科学家的认可,以推进我们的IHL-42X候选药物。他们的支持证明了IHL-42X在第二阶段概念验证研究中所显示的功效。” “正在安排的多地点临床试验是一项关键试验,这意味着它可以用于IHL-42X的监管注册和商业上市,这是经过我们广泛的贡献者团队的辛勤工作和奉献,对Incannex来说是一个令人兴奋的发展。” Hudson博士和Rosenberg博士的相关设施将作为首批临床试验地点,向美国食品和药物管理局 (FDA) 提交申请,并获得Institutional Review… Continue reading Incannex为睡眠呼吸暂停试验做出重要预约
Incannex Healthcare欢迎领先的迷幻药专家加入Clarion Clinics Group的董事会
临床阶段药物开发公司Incannex Healthcare(ASX: IHL)宣布,全球迷幻疗法和科学专家Bill Richards博士、Andrea Jungaberle博士和Matthew Johnson教授已加入其新成立的子公司Clarion Clinics Group的顾问委员会。 Richards博士在迷幻药研究、治疗和培训的最前沿拥有数十年的职业生涯,是全球众多研究团体的导师和培训师。 他在美国Johns Hopkins University共同创立了迷幻药研究小组,并在马里兰州的Sunstone Therapies担任治疗主任。 Jungaberle博士是德国Ovid Clinics的首席医疗官,也是欧洲领先的迷幻药研究和教育团体MIND基金会的共同创始人。 她已经为数百名患者进行了迷幻药辅助心理治疗,并在德国最大的迷幻药临床试验以及临床服务提供方面工作。 Johnson教授在建立约翰霍普金斯大学迷幻与意识研究中心方面发挥了核心作用,他的工作为临床迷幻科学的实践标准做出了贡献。 他是世界上发表最多的迷幻药科学家之一,经常接受国内和国际媒体的采访。 合作企业 Clarion是Incannex与澳大利亚迷幻药领袖Paul Liknaitzky博士、Suresh Sundram教授和Sean O’Carroll之间的合作企业,他们是公司的共同创始人、主要管理人员和董事。 该集团的第一家迷幻药辅助心理治疗诊所设在墨尔本,将于今年晚些时候向病人开放,之后公司打算迅速扩张。 Liknaitzky博士欢迎董事会的新成员。 “Bill、Andrea和Matt是出色的同事和鼓舞人心的人,”他说。 “他们每个人都带来了深厚的经验和来之不易的智慧,这将有助于指导我们在歌乐风险投资中的努力,支持我们的客户过上最好的生活。” 尊敬的专业人士 Incannex董事Peter Widdows说,他很高兴欢迎三位业内受人尊敬的专业人士加入Clarion。 他说:”由于澳大利亚是第一个将使用迷幻药治疗精神疾病合法化的国家,全世界都在关注我们,有这样的人才和经验加入,将有助于我们确保以道德和安全的方式提供世界领先的有效治疗。”
Incannex Healthcare公布了澳大利亚第一家迷幻药治疗诊所的计划
Incannex Healthcare (ASX: IHL)在新兴的迷幻药治疗领域有了新的突破,签署了澳大利亚第一家迷幻药辅助心理治疗诊所的租约。 通过其子公司Clarion Clinics Group,Incannex已经为其位于墨尔本内城Abbotsford河边的 “示范 “诊所获得了空间。该空间的装修和调试将很快开始,并将于2023年8月完成。 作为一个商业规模的原型,该诊所将有能力在正常工作时间内为600多名患者提供服务,基于一个为期10周的治疗计划–如果延长工作时间,则会有更多的患者。 可扩展的模式 该诊所旨在扩大规模并在其他地方复制。 “Incannex首席执行官Joel Latham说:”我们很高兴站在这个行业的前沿,这个行业有可能改变成千上万的人的生活,这些人一直生活在没有适当治疗方案的情况下。 Incannex的迷幻药诊所业务主管彼得-威多斯(Peter Widdows)说,这个开创性的企业将为那些患有 “难治性 “精神健康疾病的人实施迷幻药治疗的最佳实践。 “他说:”单独来看,这是一个实质性的商业机会,并有可能随着随后计划推出的许多诊所而扩展成一个非常有规模的企业。 着眼于600亿澳元的市场 虽然当地没有被批准的疗法,但迷幻药市场的价值预计将超过20亿澳元,在全球则高达600亿澳元。 在当地治疗药物管理局(Therapeutics Goods Administration) “下调 “用于治疗耐药性抑郁症的迷幻药(俗称魔幻蘑菇),以及用于治疗创伤后应激障碍的MDMA(又称莫利或摇头丸)后,Incannex的迷幻药治疗计划得到了扩展。 从7月1日开始生效,下调计划意味着这些物质可以由被授权的精神病医生对这两种情况进行治疗。 在此之前,该公司计划只使用氯胺酮辅助心理治疗。 得到了行业内重量级人物的验证 Incannex已经获得了澳大利亚三位领先的临床迷幻药专家的服务,他们都在临床迷幻药研究、治疗和培训方面拥有丰富的经验。 他们是D. Paul Liknaitzky、Suresh Sundram教授和Sean O’Carroll,他们将加入Clarion Clinics Group和Clarion Model Clinic的董事会,并担任重要的行政职务。 Liknaitzky博士的工作重点是创造创新的迷幻疗法和应用研究结果。 Sundram教授是一位出色的精神病学顾问,而O’Carroll先生是一位综合心理治疗师和学者,专门从事体验式、关系式和超个人心理治疗。 在临床阶段,Incannex正在开发药用大麻药物产品和迷幻药治疗,包括阻塞性睡眠呼吸暂停、创伤性脑损伤和脑震荡、肺部炎症、焦虑、疼痛和成瘾。
IHL-675A一期试验的最终结果为Incannex Healthcare计划进一步研究铺平道路
临床阶段的迷幻药和医用大麻素制药公司Incannex Healthcare(ASX: IHL)已经收到了为评估抗炎药物候选者IHL-675A的各种特性而进行的一期临床试验的最终结果,这为二期研究的规划铺平了道路。 该试验测量了该药物与参考列表药物Epidiolex(大麻二酚或CBD)和Plaquenil(羟氯喹或HCQ)相比的安全性、耐受性和药代动力学特征。 IHL-675A包括CBD和HCQ的固定剂量组合。 三个队列的12名参与者接受了IHL-675A、CBD或HCQ,每个试验组的临床评估都是相同的,以便将单个药物与IHL-675A进行比较,后者是包括两种药物成分的专有组合药物。 对参与者进行不良事件监测,并在四周内采集血样进行药代动力学分析。 耐受性良好的药物 研究发现IHL-675A耐受性良好,没有值得关注的不良事件,也没有严重不良事件的报告。 IHL-675A的治疗突发不良事件(TEAEs)的数量与Epidiolex相同。轻微的TEAEs包括腹痛、头晕、疲劳、频繁排便、头痛和嗜睡。 CBD的药代动力学 对比用IHL-675A和用Epidiolex给药的参与者的CBD平均药代动力学,发现CBD从IHL-675A吸收的速度更快,在血液中达到的最大浓度更高。 IHL-675A的CBD平均最大浓度是Epidiolex的1.57倍,而达到最大浓度的时间据说IHL-675A要快26%。 IHL-675A药物中的CBD也比Epidiolex清除得更快。 IHL-675A的CBD的半衰期比Epidiolex快13%,以IHL-675A和Epidiolex形式给药的CBD的总暴露量相似。 下一步评估 Incannex首席科学官Mark Bleackley博士说,第一阶段的安全性和药代动力学数据增加了公司对IHL-675A进行下一步评估的信心–在类风湿关节炎患者中进行120名患者的第二阶段临床试验。由于IHL-675A被认为是一种 “多用途 “候选药物,因此正在计划对其他炎症性疾病进行额外的2期试验。 “他说:”1期试验的结果是IHL-675A开发过程中的一个重要里程碑。 “关于该药物组合的安全性和药代动力学的数据对于支持第二阶段试验至关重要,该试验将看到IHL-675A在较长时期内每天对类风湿关节炎患者进行给药。” 他说,随着开发管道的不断推进,公司 “很高兴能更好地了解 “IHL-675A的治疗潜力。 积极的临床前结果 在临床前研究中已经观察到CBD和HCQ的协同抗炎活性,并被用作支持Incannex对该药申请国际专利的证据。 在临床前试验中,包括类风湿性关节炎、炎症性肠病和肺部炎症的体内模型,IHL-675A已被证明优于单独使用CBD和HCQ。 Incannex首席执行官兼总经理Joel Latham说,一大批类风湿性关节炎患者正在使用HCQ或CBD来帮助缓解症状。 “我们对安全数据和IHL-675A的独特药代动力学特征感到高兴,这可能对类风湿性关节炎患者有益。” Latham先生补充说:”通过对IHL-675A进行关键的临床研究,我们打算扰乱CBD和HCQ治疗类风湿性关节炎的市场。”
Incannex 与权威专家合作推出澳大利亚首家迷幻药诊所业务
Incannex Healthcare (ASX: IHL) 是一家临床阶段的迷幻剂和大麻素药物开发公司,该公司已宣布计划将其迷幻剂辅助心理治疗业务商业化,第一家诊所将于 2023 年在墨尔本开业。 该公司预计这种新兴治疗形式将拥有数十亿澳元的市场,并将在澳大利亚和国际范围内扩张。 Incannex 的长期董事 Peter Widdows 表示,早在治疗用品管理局 (TGA) 允许裸盖菇素和摇头丸用于治疗抑郁症和创伤后应激障碍之前,该公司一直在制定其迷幻药诊所的计划,并将领导新的子公司。 最初,Incannex 打算仅使用氯胺酮辅助心理治疗,但由于 TGA 的公告,其计划得到了扩展。 Incannex 董事总经理兼首席执行官补充说,迷幻药诊所业务是公司“一段时间以来”一直努力争取的机会,也是公司发展历程中的“关键点”。 与专家合作 作为其计划的一部分,Incannex 已与澳大利亚顶尖的临床致幻剂专家合作,包括 Paul Liknaitzky 博士、Suresh Sundram 教授和 Sean O’Carroll,他们都将加入一家子公司的董事会并在合资企业中担任关键角色。 据 Incannex 称,Liknaitzky 博士在澳大利亚建立临床迷幻药领域方面发挥了重要作用。 他的工作重点是创新迷幻疗法的创造和研究成果的应用。 Sundram 教授是一位颇有成就的心理咨询师,在迷幻剂辅助心理治疗方面拥有丰富的经验。 同时,O’Carroll 先生是一位综合心理治疗师和学者,擅长体验式、关系式和超个人心理治疗。 他为多个临床研究团队创建并提供了关于迷幻剂辅助心理治疗的培训。 Widdows 先生自 2018 年以来一直担任 Incannex 董事,并将领导该子公司。 Widdows 先生拥有丰富的商业经验,曾担任 HJ Heinz Inc 在亚洲和大洋洲大部分地区的首席执行官。 2023 年墨尔本诊所开业,随后进行国际扩张… Continue reading Incannex 与权威专家合作推出澳大利亚首家迷幻药诊所业务